DNA甲基化是最早被發(fā)現(xiàn)�����、也是研究最深入的表觀遺傳調(diào)控機(jī)制之一。第一個(gè)被發(fā)現(xiàn)的5-甲基胞嘧啶(5mC)是研究最多的修飾堿基���,它在從基因調(diào)控到正常發(fā)育的廣泛生物過(guò)程中發(fā)揮著重要作用����,被認(rèn)為是第五個(gè)堿基��。5-羥甲基胞嘧啶(5hmC)是由5mC經(jīng)過(guò)TET家族酶氧化而來(lái)�,在神經(jīng)元細(xì)胞含量較高,被認(rèn)為是第六堿基�����。
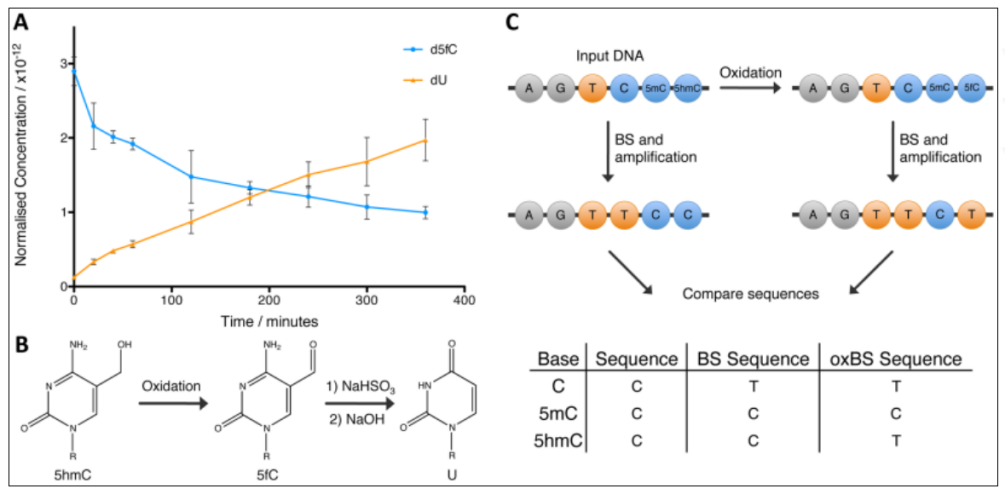
DNA甲基化修飾在維持正常細(xì)胞的功能�����、雌性個(gè)體X染色體失活����、寄生DNA序列的抑制����、基因組結(jié)構(gòu)穩(wěn)定���、遺傳印記、胚胎發(fā)育�、及腫瘤和疾病的發(fā)生、發(fā)展緊密相關(guān)�����,具有至關(guān)重要的作用����。5mC可以導(dǎo)致基因沉默或基因表達(dá)水平降低,因此����,腫瘤抑癌基因的過(guò)甲基化或原癌基因的低甲基化在多種腫瘤中被發(fā)現(xiàn)。而5hmC作為去甲基化過(guò)程的第一步��,則會(huì)導(dǎo)致基因激活或基因表達(dá)水平增高����,研究表明DNA的5hmC在多種腫瘤中有明顯降低。因此���,分析基因組的5mC和5hmC水平具有重要的臨床意義��。WGBS(Whole-genome bisulfite sequencing)被視為甲基化測(cè)序的“金標(biāo)準(zhǔn)”��,主要檢測(cè)5mC和5hmC兩種修飾形式����。在此基礎(chǔ)上衍生出了的一些方法用來(lái)區(qū)分5mC和5hmC,比如氧化亞硫酸氫鹽測(cè)序(oxBS-seq)被用于5mC特異性測(cè)序����,以及TET輔助的重亞硫酸鹽測(cè)序(TAB-seq)特異性檢測(cè)5hmC。近年來(lái)��,基于酶法轉(zhuǎn)化的甲基化測(cè)序技術(shù)不斷涌現(xiàn)出來(lái)�,APOBEC偶聯(lián)甲基化表觀測(cè)序 (ACE-seq)可以特異性檢測(cè)5hmC,以及酶法甲基化測(cè)序(EM-seq)可同時(shí)檢測(cè)5mC和5hmC����。TAPS技術(shù)一改之前將未發(fā)生甲基化修飾的C轉(zhuǎn)化未U的方法�,創(chuàng)新性的實(shí)現(xiàn)了正向檢測(cè)甲基化位點(diǎn)的測(cè)序技術(shù),其衍生技術(shù)TAPSβ及CAPS���,亦可實(shí)現(xiàn)5mC和5hmC的區(qū)分���,具有巨大的潛力�。該技術(shù)在將傳統(tǒng)的BS-Seq技術(shù)與化學(xué)氧化相結(jié)合���,先利用高釕酸鉀KRuO4將DNA上的5hmC氧化成5fC�����,再用重亞硫酸鹽處理��,5fC和沒(méi)有任何修飾的C就被轉(zhuǎn)化成U����,而5mC則不會(huì)被轉(zhuǎn)化����,仍然保持為C。如此則可以特異性的檢測(cè)5mC���,BS-Seq和oxBS-Seq聯(lián)合測(cè)序也可實(shí)現(xiàn)對(duì)5hmC單堿基分辨率的檢測(cè)�����。其技術(shù)原理示意圖如下(圖1):圖1.oxBS-seq 5mC單堿基分辨率測(cè)序(Booth, M. J. et al.2012, Science)TET輔助的重亞硫酸鹽測(cè)序(TAB-seq)
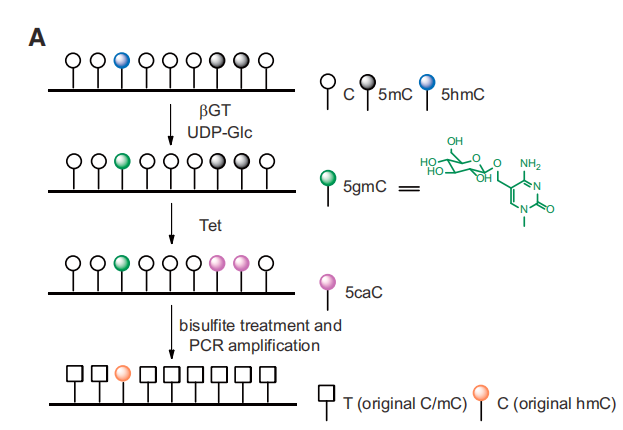
用糖基把羥甲基化的C給保護(hù)起來(lái)�����,然后用TET蛋白(Ten-eleven translocation methylcytosine dioxygenase 1)����,把甲基化的C轉(zhuǎn)化成羥基化的C,進(jìn)一步將羥甲基化的C轉(zhuǎn)化成甲?����;腃和羧基化的C��。甲?����;腃和羧基化的C都可以被亞硫酸氫鹽轉(zhuǎn)化成U��。而之前被糖基化保護(hù)起來(lái)的羥甲基化的C��,是不會(huì)被TET蛋白轉(zhuǎn)化成甲?���;腃或者羧基化的C的�。在亞硫酸氫鹽的處理過(guò)程中,它還保持是C����。并且在之后的PCR擴(kuò)增產(chǎn)物中���,也表現(xiàn)為C。這樣��,就可以把羥甲基化的C和甲基化的C給區(qū)分開(kāi)來(lái)����,從而特異性的檢測(cè)5hmC。其技術(shù)原理示意圖如圖(圖2):圖2.TAB-seq 5hmC單堿基分辨率測(cè)序 (Yu, M. et al. 2012, Cell)APOBEC偶聯(lián)甲基化測(cè)序(ACE-seq)
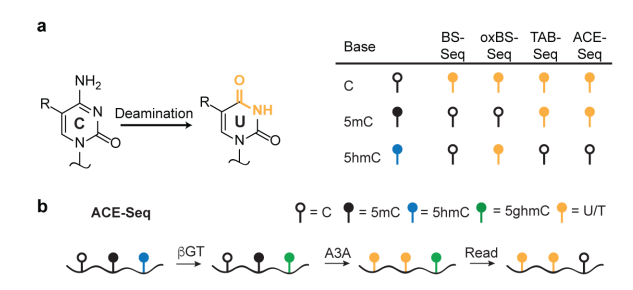
不同于傳統(tǒng)的BS-Seq����,該技術(shù)使用AID/APOBEC家族DNA脫氨酶APOBEC3A (A3A)代替化學(xué)脫氨,保證了DNA的完整性��。首先���,利用T4 β-葡糖基轉(zhuǎn)移酶(βGT)將5hmC轉(zhuǎn)化成5ghmC����,5ghmC不會(huì)被A3A酶脫氨基�,這樣A3A能夠特異地脫去C及5mC的氨基使其變?yōu)閁,而5ghmC則因?yàn)椴槐辉撁缸R(shí)別,測(cè)序時(shí)仍被檢測(cè)為C����。這樣,可將5hmC與C及5mC區(qū)分開(kāi)來(lái)���,實(shí)現(xiàn)特異性檢測(cè)5hmC��。該技術(shù)原理示意圖如下(圖3):圖3.ACE-seq 5hmC單堿基分辨率測(cè)序(Schutsky, E. K. et al. 2018, Nat. Biotechnol)全基因組重亞硫酸鹽測(cè)序(WGBS)長(zhǎng)期以來(lái)一直是甲基化圖譜分析的金標(biāo)準(zhǔn)��,但重亞硫酸鹽的化學(xué)反應(yīng)會(huì)破壞和降解DNA�,導(dǎo)致DNA斷裂和丟失��?;诿阜ǖ募谆瘻y(cè)序就克服了這個(gè)缺點(diǎn)。Enzymatic Methyl-seq(EM-seq)通過(guò)酶法完成WGBS建庫(kù)�����,其對(duì)DNA的酶處理分為兩步:第一步使用TET2酶以及氧化增強(qiáng)劑將5mC和5hmC氧化成5caC��,保護(hù)經(jīng)過(guò)修飾的胞嘧啶�����;第二步利用脫氨酶APOBEC對(duì)胞嘧啶進(jìn)行脫氨處理,此步驟不會(huì)對(duì)5caC造成影響�,從而實(shí)現(xiàn)5mC和5hmC的檢測(cè)����。其技術(shù)原理示意圖如下(圖4):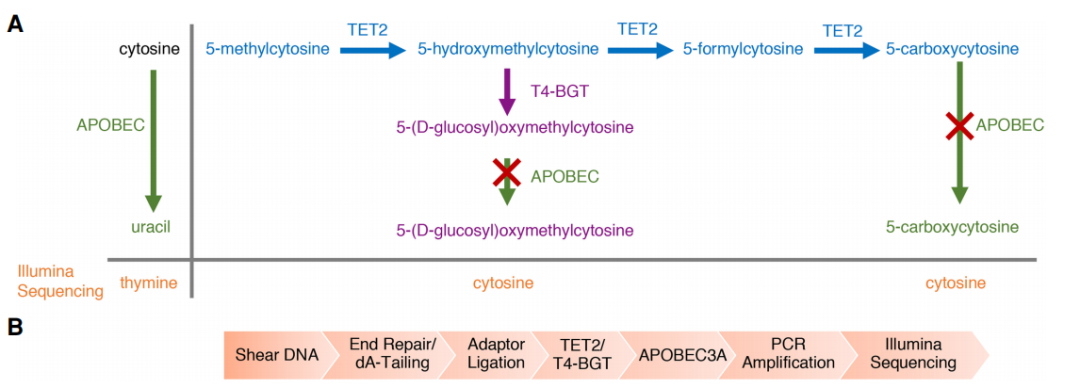
圖4.EM-seq 單堿基分辨率測(cè)序(Vaisvila, R. et al.2020, bioRxiv)TET輔助吡啶硼烷測(cè)序(TAPS)(TET-assisted pyridine borane sequencing)、TAPSβ及CAPS
在TAB-seq中講到TET蛋白可以把甲基化的C轉(zhuǎn)化成羥基化的C���,進(jìn)一步將羥甲基化的C轉(zhuǎn)化成甲?���;腃和羧基化的C�。TAPS技術(shù)發(fā)現(xiàn)5caC可以被吡啶硼烷及衍生物(Pyridine borane)還原為二氫尿嘧啶(dihydrouracil,DHU)��,而DHU在鏈擴(kuò)增方面與自然的U堿基并沒(méi)有差異�,這樣經(jīng)過(guò)PCR擴(kuò)增DHU可以轉(zhuǎn)化為T(mén),從而到達(dá)不用亞硫酸鹽處理將甲基化的C堿基轉(zhuǎn)為T(mén)堿基的目的��。TAPS得到的DNA文庫(kù)復(fù)雜度高(僅把占比很小的甲基化C進(jìn)行了改變�����,對(duì)DNA的天然序列改變很小�,堿基平衡),避免了bisulfite法引起的DNA損傷及文庫(kù)的不平衡,對(duì)Illumina測(cè)序儀更加友好���,數(shù)據(jù)質(zhì)量較高��。TAPS的衍生方法TAPSβ及CAPS可分別用于檢測(cè)5mC和5hmC����。TAPSβ也是用糖基化酶把羥甲基化的C給保護(hù)起來(lái)��,使其免受TET氧化���。再使用TET酶將甲基化的C轉(zhuǎn)化羥甲基化的C在轉(zhuǎn)化成甲?����;腃和羧基化的C���。5caC則可在吡啶硼烷還原為二氫尿嘧啶,而被保護(hù)起來(lái)的羥甲基化的C則不變���。經(jīng)過(guò)后續(xù)步驟測(cè)序則可特異性的區(qū)分5mC��。CAPS技術(shù)仍利用利用了oxBS-seq中高釕酸鉀KRuO4將DNA上的5hmC氧化成5fC�����,經(jīng)吡啶硼烷的衍生物(pic-borane)5fC還原成二氫尿嘧啶��,從而實(shí)現(xiàn)特異性的檢測(cè)5hmC���。該系列技術(shù)原理示意圖如下(圖5):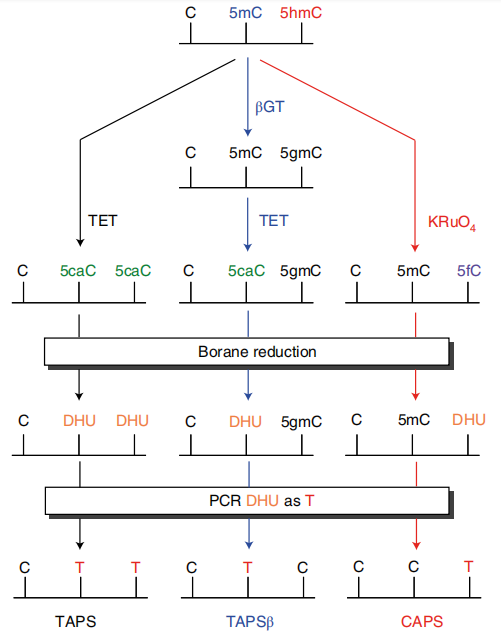 圖5.TAPS、TAPSβ��、CAPS 單堿基分辨率測(cè)序(Liu, Y. et al.2021, Nat Commun)
圖5.TAPS、TAPSβ��、CAPS 單堿基分辨率測(cè)序(Liu, Y. et al.2021, Nat Commun)
以上就是幾種對(duì)于5mC和5hmC測(cè)序方法����,隨著高通量測(cè)序技術(shù)的發(fā)展以及新技術(shù)的不斷涌現(xiàn),甲基化檢測(cè)技術(shù)將在癌癥早期診斷及篩查領(lǐng)域有更廣闊的發(fā)展前景����。產(chǎn)品名稱(chēng) | 產(chǎn)品編號(hào) | 規(guī)格 |
Hieff NGS? Methyl-seq DNA library Prep kit for Illumina? | 12211ES08 | 8T |
12211ES24 | 24T |
12211ES96 | 96T |
Hieff Canace? 耐U+高保真DNA聚合酶 | 10145ES60 | 100 U |
10145ES76 | 500 U |
[1] Booth, M. J. et al. Quantitative sequencing of 5-methylcytosine and 5-hydroxymethylcytosine at single-base resolution. Science 336, 934–937 (2012).
[2] Yu, M. et al. Base-resolution analysis of 5-hydroxymethylcytosine in the mammalian genome. Cell 149, 1368–1380 (2012).
[3] Schutsky, E. K. et al. Nondestructive, base-resolution sequencing of 5-hydroxymethylcytosine using a DNA deaminase. Nat. Biotechnol. 36,1083–1090 (2018).
[4] Vaisvila, R. et al. EM-seq: detection of DNA methylation at single base resolution from picograms of DNA. Preprint at bioRxiv https://doi.org/ 10.1101/2019.12.20.884692 (2020).
[5] Liu, Y., Hu, Z., Cheng, J. et al. Subtraction-free and bisulfite-free specific sequencing of 5-methylcytosine and its oxidized derivatives atbase resolution. Nat Commun 27;12(1):618(2021).